https://drive.google.com/file/d/0BynVQ2R2q4rHWUgyeVBQU3BkLThQMU5FLW1WT1JVZFRiMGxv/view?usp=sharing
jueves, 9 de noviembre de 2017
viernes, 3 de noviembre de 2017
SEMANA #35
RESPONDER LAS SIGUIENTES PREGUNTAS CON LO OBSERVADO EN EL APP ANTERIOR
1. LAS SOLUCIONES QUE CONDUCEN LA ELECTRICIDAD SE DENOMINAN:
1. LAS SOLUCIONES QUE CONDUCEN LA ELECTRICIDAD SE DENOMINAN:
2. A QUÉ SE DEBE QUE EL BOMBILLO ALUMBRE MÁS?
3. A QUÉ SE DEBE QUE EL BOMBILLO SE PRENDA?
Ninguna de las anteriores
SOLUCION
1 R/: ELECTROLITOS
2 R/:HAY MUCHA SAL
3 R/: A LA PRESENCIA DE IONES NEGATIVOS Y POSITIVOS
Las son una mezcla homogénea de dos o más sustancias en las cuales el componente que se encuentra en menor proporción es el y el componente que se encuentra en mayor proporción es el , a la cantidad máxima de soluto que se disuelve en 100g de agua a una temperatura determinada se le llama y al proceso mediante el cual las moléculas del agua rodean a las partículas del soluto para disolverla se denomina . cuando se quiere formar una solución, entre los químicos hay una expresión para predecir la solubilidad de las sustancias; lo e disuelve a lo y el solvente universal es el .
R/ : Las coluciones
soluto
solvente
solubilidad
solvatacion
disuelve
semejante
agua
soluto
solvente
solubilidad
solvatacion
disuelve
semejante
agua
martes, 31 de octubre de 2017
SEMANA #34
REALIZAMOS UN QUIZ DE NORMALIDAD Y MORALIDAD.


Rellenar huecos, OBSERVE LA GRÁFICA Y RESPONDA
Lea el párrafo que aparece abajo y complete las palabras que faltan.
SEMANA #33
Luego de observar el vídeo, responde las siguientes preguntas
1. Cuáles son las características de una solución?
2. Cuáles son sus componentes?
3. Mensione otros disolventes diferentes al agua que se pueden utilizar en soluciones
4. Qué es la solubilidad y que factores la afectan?
5. A qué se llaman soluciones empíricas y como se dividen?
6. Que son las soluciones valoradas y cuales se mencionan en el vídeo?
SOLUCION
1.R/: -Presentan una sola fase, es decir, son homogéneas.
- -Están formados por dos componentes: soluto y solvente.
2 R/: soluto, solvente y solubilidad
3 R/:Etanol, acetona, y el ete
*solución diluidas
*solución concentrada
*solución saturada
*solución sobre saturada
6 R/: *soluciones porcentuales
*soluciones molares
martes, 24 de octubre de 2017
SEMANA #32
LA NORMALIDAD
N= equivalentes soluto/L de solución. Ahora para saber cuánto pesa un equivalente , se utiliza la otra fórmula que es: Peso equivalente gramo = masa atómica/ equivalente/mol . Reemplazado unidades de masa atómica Queda: Peso equivalente gramo= g/mol /equivalente/mol
LA MORALIDAD
(M), o concentración molar, es el número de moles de soluto por cada litro de disolución. Por ejemplo, si se disuelven 0,5 moles de soluto en 1000 mL de disolución, se tiene una concentración de ese soluto de 0,5 M (0,5 molar).
N= equivalentes soluto/L de solución. Ahora para saber cuánto pesa un equivalente , se utiliza la otra fórmula que es: Peso equivalente gramo = masa atómica/ equivalente/mol . Reemplazado unidades de masa atómica Queda: Peso equivalente gramo= g/mol /equivalente/mol
Normalidad (N) =
| nº EQ (equivalentes-gramo) |
Litros de disolución
. |
- Ejemplo 1: Calcular la normalidad y la molaridad de 50 gramos de Na2CO3 en 100 ml de disolución:
- Normalidad (N):
- Peso molecular del Na2CO3 = 106
- Equivalente del Na2CO3 = peso molecular / nº de carga del catión de la sal = 106 / 2 = 53
- nº de Equivalentes en 50 g de Na2CO3 = 50 / 53 = 0,94
- N = nº de Equivalentes / litros de disolución = 0,94 / 0,1 = 9,4 N
- Molaridad (M):
- Moles de soluto = masa soluto / peso molecular = 50 / 106 = 0,47 moles
- M = moles soluto / litros disolución = 0,47 / 0,1 = 4,7 M (M = N/2 en este caso)
LA MORALIDAD
(M), o concentración molar, es el número de moles de soluto por cada litro de disolución. Por ejemplo, si se disuelven 0,5 moles de soluto en 1000 mL de disolución, se tiene una concentración de ese soluto de 0,5 M (0,5 molar).
- Ejemplo 1: calcular la molaridad de una disolución que contiene 2,07·10-2 moles de soluto en 50 ml de disolvente:
- molaridad = M = n / V = 2,07·10-2 moles / 0,05 litros = 0,414 molar
SEMANA #31
LAS SOLUCIONES
(o disoluciones) químicas. Una solución (o disolución) es una mezcla de dos o más componentes , perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales
ALGUNA VEZ TE HAS PREGUNTADO ¿QUÉ CONTIENE EL AIRE?¿QUÉ HAY EN LA LECHE?¿QUÉ FORMA EL BRONCE?¿QUÉ TIENEN LOS LIMPIADORES?¿CUÁL ES LA COMPOSICIÓN DEL AGUA DE MAR? OBSERVA LAS IMÁGENES Y TRATA DE RESPONDER LO PLANTEADO.





R/ la contaminación.
la leche de vaca es muy mala porque contiene pus y sangre ademas también contiene hormonas femeninas.
el bronce tiene como base el cobre estaño y elementos como el zinc.
los limpiadores tienen la función de limpiar por ende se utilizan muchos componentes químicos, ademas me parece que son tóxicos.
el agua de mar es muy salada osea el sodio y el cloro son los que predominan.
(o disoluciones) químicas. Una solución (o disolución) es una mezcla de dos o más componentes , perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales
ALGUNA VEZ TE HAS PREGUNTADO ¿QUÉ CONTIENE EL AIRE?¿QUÉ HAY EN LA LECHE?¿QUÉ FORMA EL BRONCE?¿QUÉ TIENEN LOS LIMPIADORES?¿CUÁL ES LA COMPOSICIÓN DEL AGUA DE MAR? OBSERVA LAS IMÁGENES Y TRATA DE RESPONDER LO PLANTEADO.





R/ la contaminación.
la leche de vaca es muy mala porque contiene pus y sangre ademas también contiene hormonas femeninas.
el bronce tiene como base el cobre estaño y elementos como el zinc.
los limpiadores tienen la función de limpiar por ende se utilizan muchos componentes químicos, ademas me parece que son tóxicos.
el agua de mar es muy salada osea el sodio y el cloro son los que predominan.
viernes, 6 de octubre de 2017
SEMANA #27

SE REALIZO UN EXAMEN DE ECUACION POR REDOX
CONTINUACIÓN DE ESTEQUIOMETRIA:
En la estequiometria cuando nos proyectan por el volumen en litros de un gas debemos recordar lo que avogrado planteaba.
SEMANA #26



SE REALIZO UN EXAMEN DE ECUACION POR REDOX
CONTINUACIÓN DE ESTEQUIOMETRIA:
En la estequiometria cuando nos proyectan por el volumen en litros de un gas debemos recordar lo que avogrado planteaba.

SEMANA #25
BALANCEO POR TANTEO
AGOTE: El agente oxidante toma electronesARDE: El agente reductor dona electrones
SUSTANCIA OXIDADA: Agente oxidada, la que contiene agente reductor
SUSTANCIA REDUCIDA: La que contiene el agente oxidante
NOTA:*Cuando una ecuación no se puede balancear de reactivos a productos se invierte el proceso es decir se debe balancear de productos a reactivos
*Cuando en una misma molécula un átomo gana y en otro pierde electrones se resta de mayor en menor y se calcula la dirección en sentido contrario
*Si los dos átomos gana o los dos átomo pierden electrones se suman ambos.
PUREZA Y EFICIENCIA
PUREZA: Es cuando un reactivo y tiene un porcentaje de impureza(sustancia que obtiene el reactivo que hace que no sea pura).no deben decir que porcentaje hay de reactivo puro o de las impurezas. hay que sacar el porcentaje de pureza antes de el problema dicho.
EFICIENCIA: Ninguna reacción química debe ser 100% da menos productos del que yo deseo obtener :
*condición que se lleva acabo una reacción
MÉTODO DE SEPARACIÓN
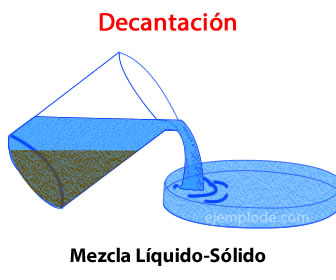
DECANTACIÓN: Se emplea para separar líquidos con densidades diferentes y que no se mezclan entre sí (inmiscibles), como el agua y el aceite. En estos casos, se utiliza un embudo de decantación.-Se vierte la mezcla en el embudo de decantación, asegurándonos antes de que la llave de la parte inferior está cerrada (en posición horizontal), para que la mezcla no salga mientras la vertemos.
-Se deja reposar hasta que ambos líquidos se separan bien.-Se coloca un vaso de precipitados debajo del embudo y se abre la llave. Empezará a salir el líquido más denso (es decir, el que está en la parte inferior de la mezcla).-Cerramos la llave en cuanto haya pasado todo este primer líquido.
-El líquido menos denso seguirá en el embudo. Para recuperarlo, conviene sacarlo por la parte superior de este; así evitaremos contaminarlo con los restos de la otra sustancia que hayan podido quedar en la llave.
-El líquido menos denso seguirá en el embudo. Para recuperarlo, conviene sacarlo por la parte superior de este; así evitaremos contaminarlo con los restos de la otra sustancia que hayan podido quedar en la llave.
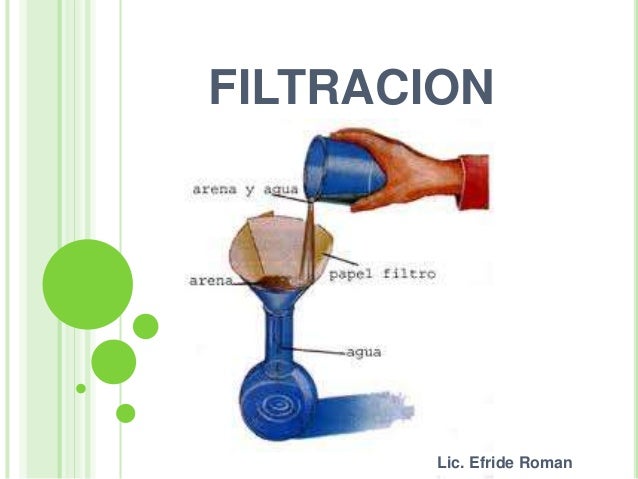
FILTRACIÓN:
Este método se usa para separar un sólido de un líquido en el cual no se disuelve (no es soluble en él), como la arena en suspensión en el agua. Para ello, se hace pasar la mezcla heterogénea a través de un filtro con un tamaño de poro adecuado (menor que el de las partículas que queremos separar). Habitualmente se emplea un papel de filtro acoplado a un embudo
La filtración tiene múltiples aplicaciones tanto a nivel industrial como doméstico. Algunos ejemplos son:
-Filtración del té y otras infusiones
-Filtración del café para separar los granos
-Filtración del agua para potabilizarla
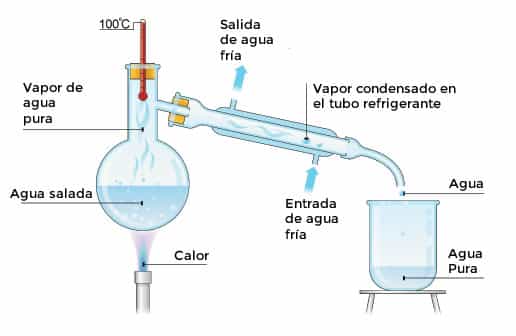
DESTILACIÓN:
Se utiliza para separar líquidos solubles entre sí que tienen temperaturas de ebullición muy diferentes, como el agua y el alcohol La mezcla se vierte en un matraz esférico (o de fondo redondo) y se calienta. Cuando se alcanza la temperatura de ebullición más baja de los componentes, este comienza a convertirse en vapor y pasa por el refrigerante, donde se enfriará y condensará. El líquido resultante, llamado destilado, se recoge en un recipiente (un vaso de precipitados, por ejemplo)
EVAPORACIÓN Y CRISTALIZACIÓN:
Se emplea para separar un soluto sólido disuelto en un disolvente líquido, como la sal en el agua. El proceso comienza con la evaporación del disolvente (natural o forzada mediante calefacción) y acaba con la deposición en el fondo del recipiente (generalmente, un cristalizador) del sólido en forma de cristales. Cuanto más lenta sea la evaporación del disolvente, más grandes serán los cristales.

SEMANA #24
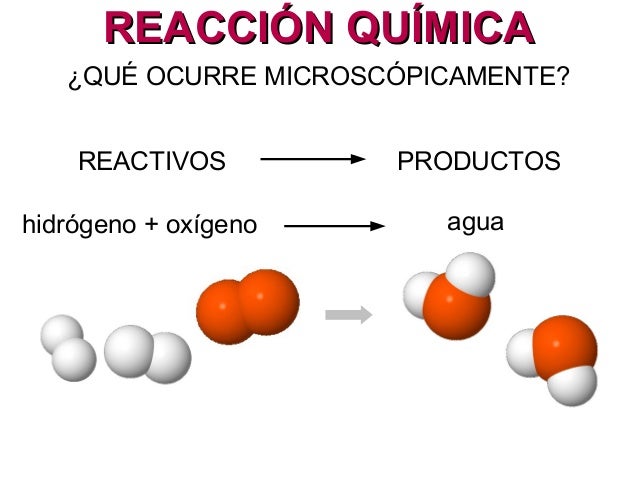
REACCIÓN QUÍMICA
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual una o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias, llamadas productos.
SEMANA #23
BALANCEO POR REDOX.
El método del cambio de los números de la oxidación es relativamente sencillo, y es un modo fácil de equilibrar las ecuaciones redox. Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.
Las reglas para introducir las ecuaciones
- Los espacios entre los símbolos y las fórmulas se ignoran, por ejemplo: c en so4 es idéntico cuso4
- Se permite el uso de todos tipos de paréntesis, como por ejemplo: K3[Fe(CN)6]
- Cuando se escriben iones, añadan simplemente la carga al final de la fórmula, como por ejemplo: Hg2+, Hg22+, or Hg2^2+
- Como flecha en la ecuación pueden utilizar la señal "=" o "-->" o "→".
- La entera ecuación se puede escribir con minúsculas. Los elementos, escritos correctamente (la primera letra escrita con mayúscula) el convertidor dejará sin cambios, de mismo modo como lo han escrito ustedes.
¿Por qué tenemos que equilibrar la reacción química?
La ecuación química equilibrada describe exactamente las cantidades de los reactantes y productos en una reacción química. La ley sobre la conservación de la masa dice que en la reacción química la masa no se puede ni producir ni destruir. Esto significa que la ecuación química debe tener por ambos lados el mismo número de átomos de cada elemento. Para que una ecuación esté equilibrada, las sumas de las cargas eléctricas en ambos lados tienen que ser idénticas.
Instrucciones para equilibrar las ecuaciones redox
- Paso 1. Se escribe una reacción desequilibrada
- Paso 2. Se desmonta la reacción redox a las reacciones parciales
- a) Se determinan los números de la oxidación de cada átomo respectivo.
- b) Se identifican los pares redox en la reacción
- c) Se escribe la transferencia de los electrones
- d) Se combinan los pares redox en dos reacciones parciales
- Paso 3. Se equilibran los átomos en las ecuaciones parciales
- a) Se equilibran todos los átomos excepto del H y del O
- b) Se equilibran las cargas añadiendo H+ o OH-
- b) Se equilibran los átomos del oxígeno añadiendo H2O
- Paso 4: Se iguala el número de los electrones perdidos y recibidos en las reacciones parciales
- Paso 5: Se suman las ecuaciones parciales
- Paso 6: Se acorta la ecuación
- Y al final, siempre se verifica el equilibrio de las cargas y de los elementos
sábado, 12 de agosto de 2017
SEMANA #22
LEY DE LA CONSERVACION DE LA MATERIA
La ley de la Conservación de la Materia, es también llamada ley de conservación de la masa o Ley de Lomonósov-Lavoisier, en honor a sus creadores. ... La materia es el término general que se aplica a todo lo que ocupa espacio y posee los atributos de gravedad e inercia.

LEY DE LAS PROPORCIONES DEFINIDAS
se expresa así: “Diferentes átomos se combinan en relaciones simples de números enteros para formar compuestos”. Dicho de otra manera, un compuesto siempre está constituido por los mismos elementos y en la misma proporción en masa.

LEY DE LAS PROPORCIONES MUTIPLES
Fue demostrada el químico y físico francés Louis Joseph Gay-Lussac. Dice: Cuando dos o más elementos se combinan para dar más de un compuesto, una masa variable de uno de ellos se une a una masa fija del otro, y la primera tiene como relación números canónicos e indistintos.

LEY DE GAY-LUSSAC
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800. Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante. La presión del gas es directamente proporcional a su temperatura: Si aumentamos la temperatura, aumentará la presión.

SEMANA #21
QUE ES LA ESTEQUIOMETRIA
La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa en la que los elementos químicos que están implicados. En una reacción química se observa una modificación de las sustancias presentes: los reactivos se consumen para dar lugar a los productos.
Poner al día el blog, como se ha explicado que se debe hacer.
2. Resolver al acumulativo en el cuaderno, sustentando las respuestas. Todas.
3. Hacer un archivo HTML que contenga lo siguiente:
a. Contenido explicativo del tema( tabla periódica, propiedades periódicas y nomenclatura
inorgánica con todas las funciones).
b. Hacer un formulario de 20 preguntas con respuesta de selección múltiple.(temas del periodo)
c. Que el sistema pueda calificar y visualizar el puntaje obtenido.
d. Cada respuesta correcta tiene un valor de 0,25
4. El documento debe contener :
* Minimo un video (indicar la fuente)
* Un fondo de imagen alusivo al tema
*Las tablas de nomenclatura no pueden ser imágenes
*Tiene qe ser una tabla con la función <TABLE> </TABLE>
Se debe tener listo para el martes 28 de Agosto de 2017. La presentación es la sustentación.
viernes, 28 de julio de 2017
grupo 6
tema: hidracidos oxacidos
integrantes :
*laura villegas
*natalia aguirre
*susana correa
Ácidos Hidrácidos :
Son compuestos formados por un no metal, trabajando con su menor valencia, e hidrógeno.
Para el nombre tradicional, se escribe ÁCIDO seguido del no metal terminado en HIDRICO.
En el caso de la nomenclatura moderna, se le agrega el sufijo URO al no metal, y luego preposición “de” y la palabra HIDRÓGENO.
NO METAL + HIDRÓGENO —–> ÁCIDO HIDRÁCIDO
Ej: HCl Nomenclatura Tradicional: Acido clorhidrico
Nomenclatura Stock: Cloruro de hidrógeno
Nomenclatura Estequiometrica: Cloruro de hidrogeno
HBr Nomenclatura Tradicional: Acido Bromhidrico
Nomenclatura Stock: Bromuro de Hidrogeno
Nomenclatura Estequiometrica:
Ácidos Oxácidos:
Compuestos que resultan de la combinación de un anhídrido con agua. Están formados por hidrógeno y un radical ( no metal y oxígeno ) . El nombre tradicional se obtiene cambiando la palabra óxido porÁCIDO y el nombre del anhidrido de donde se obtuvo el acido.
ÓXIDO ÁCIDO O ANHÍDRIDO + AGUA —-> ÁCIDO OXÁCIDO
Para el nombre stock, se siguen las siguientes normas:
Se escribe la palabra ÁCIDO
Se coloca el prefijo que indique el número de oxigenos seguido de la terminación OXO
Se escribe el nombre del elemento no metálico terminado en ICO
Al final se escribe la valencia o número de oxidación en números romanos entre paréntesis del elemento central.
grupo 7
tema:las sales-los acidos
integrantes:
*juan andres cataño
*andres felipe
*juan manuel lopera
*saniel tamayo
las sales
Las sales son compuestos químicos salinos, tal como se denomina a aquellos que contienen sal o disponen de las características típicas de esta sustancia, que pueden ser orgánicos o inorgánicos. En tanto, la sal es un tipo de compuesto químico que se encuentra conformado por cationes, que son iones de carga positiva, que a su vez están enlazados con aniones, iones que disponen de carga negativa.
Uno de los tipos de sales más populares es la que en el lenguaje corriente denominamos sal de mesa, sal común, la cual implica cloruro de sodio, una sustancia de color blanco, cristalina, soluble en agua, que podemos encontrar en el agua de mar o en algunas otras masas sólidas y que se usa mayormente como condimento de las comidas. Cabe destacar, que la sal nos proporciona uno de los sabores básicos, el salado, el cual es sentido gracias a los receptores dispuestos en nuestra lengua que nos permiten hacerlo.
los acidos
un acdo es una sustancia que, en disolucion, incrementa la consentracion de iones de hidrogeno.en conbinacion con las bases, un acido permite formar sales
Ejemplo:
Ácido Fosfórico H3PO3
Ácido Cítrico C6H8O7
Ácido Sulfúrico H2SO4
En esta semana continuamos las exposiciones y se finalizaron con exito
grupo 5
tema: propiedades periodicas
conformado por:
*any guzman
*juanpablo zapata
*andres cardona
*esteban gaviria
*jorge miguel
propiedades periodicas
Son propiedades que presentan los átomos de un elemento y que varían en la Tabla Periódica siguiendo la periodicidad de los grupos y periodos de ésta. Por la posición de un elemento podemos predecir qué valores tendrán dichas propiedades así como a través de ellas, el comportamiento químico del elemeneto en cuestión.
SEMANA #!8
grupo 4
tema:nomenclatura reacciones de ocidos y bases
integrantes:
mariano andres perez
william perez
cintjia celis
yeison calle
Una reacción ácido-base o reacción de neutralización es una reacción química que ocurre entre un ácido y una base produciendo una sal y agua. La palabra "sal" describe cualquier compuesto iónico cuyo catión provenga de una base (Na+ del NaOH) y cuyo anión provenga de un ácido (Cl- del HCl).
SEMANA #17
En este dia el equipo #3 tambien realizo la exposicion
integrantes:
JUAN CARLOS PIEDRAHITA
SANTIAGO AVENDAÑO GARCIA
DANIEL ZAPATA SERNA
ENLACES QUÍMICOS
Un enlace químico corresponde a la fuerza que une o enlaza a dos átomos, sean estos iguales o distintos. Los enlaces se pueden clasificar en tres grupos principales: enlaces iónicos, enlaces covalentes y enlaces dativos. Los enlaces se producen como resultado de los movimientos de los electrones de los átomos, sin importar el tipo de enlace que se forme. Pero no cualquier electrón, puede formar un enlace, sino solamente los electrones del último nivel energético (más externo). A estos se les llama electrones de valencia. En este capítulo analizaremos las características de cada tipo de enlace, como también veremos diferentes maneras de representarlos en el papel. Partiremos definiendo lo que es un enlace iónico.
ESTRUCTURA DE LEWIS
La estructura de Lewis, también llamada diagrama de punto y raya diagonal, modelo de Lewis, representación de Lewis o fórmula de Lewis, es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir.
SEMANA #17
En esta semana el grupo #2 realizo su respectiva exposicion
integrantes:
JUN JOE ARISTIZABAL
KAMILO ARANGO
RICARDO RINCON
LUIS GUSTAVO SUÑIGA
click aqui
martes, 2 de mayo de 2017
SEMANA #14
REFLEXIÓN SOBRE EL DÍA DE LA TIERRA
Hay que cuidar el planeta porque todo lo que nosotros sentimos,respiramos en por causa de nosotros hay que cuidarlo si queremos buen estado de nuestro ambiente ,no tiremos basuras cuidemos nuestro PLANETA.
DISTRIBUCIÓN ELECTRÓNICA
Las distribuciones electrónicas sirven para ubicar a los electrones en los correspondientes niveles y subniveles de energía y orbitales. Los niveles K, L, M, N, O, P y Q toman valores de 1, 2, 3, 4, 5, 6 y 7 respectivamente; y los subniveles de energía se corresponden con las letras s, p, d,f.

Hay que cuidar el planeta porque todo lo que nosotros sentimos,respiramos en por causa de nosotros hay que cuidarlo si queremos buen estado de nuestro ambiente ,no tiremos basuras cuidemos nuestro PLANETA.
DISTRIBUCIÓN ELECTRÓNICA
Las distribuciones electrónicas sirven para ubicar a los electrones en los correspondientes niveles y subniveles de energía y orbitales. Los niveles K, L, M, N, O, P y Q toman valores de 1, 2, 3, 4, 5, 6 y 7 respectivamente; y los subniveles de energía se corresponden con las letras s, p, d,f.

SEMANA #13
PRINCIPIO DE EXCLUSIÓN DE PAULI
El principio de exclusión de Pauli es una regla de la mecánica cuántica enunciada por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico) dentro del mismo sistema cuántico.
PRINCIPIO DE MULTIPLICIDAD
Al llenar orbitales de igual energía (los tres orbitales p, los cinco d, o los siete f) los electrones se distribuyen, siempre que sea posible, con sus espines paralelos, llenando los orbitales con la multiplicidad mayor.
El principio de exclusión de Pauli es una regla de la mecánica cuántica enunciada por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico) dentro del mismo sistema cuántico.
PRINCIPIO DE MULTIPLICIDAD
Al llenar orbitales de igual energía (los tres orbitales p, los cinco d, o los siete f) los electrones se distribuyen, siempre que sea posible, con sus espines paralelos, llenando los orbitales con la multiplicidad mayor.
SEMANA #12
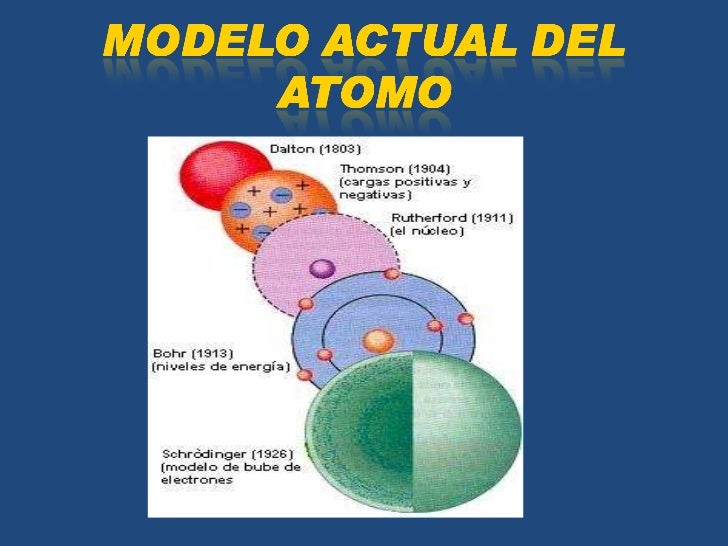
EL MODELO ACTUAL DEL ÁTOMO
Modelo atómico actual. Fué desarrollado durante la decada de 1920, sobre todo por Schrödinger y Heisenberg. Es un modelo de gran complejidad matemática, tanta que usándolo sólo se puede resolver con exactitud el átomo de hidrógeno. Para resolver átomos distintos al de hidrógeno se recurre a métodos aproximados.
PRIMER NUMERO CUÁNTICO (n)
Especifica el nivel energético del orbital, siendo el primer nivel el de menor energía, y se relaciona con la distancia promedio que hay del electrón al núcleo en un determinado orbital. A medida que n aumenta, la probabilidad de encontrar el electrón cerca del núcleo disminuye y la energía del orbital aumenta.
Número cuántico secundario (ℓ)
Describe la forma geométrica del orbital. Los valores de l dependen del número cuántico principal. Puede tomar los valores desde ℓ = 0 hasta ℓ =n-1. En el caso de los átomos con más de un electrón, determina también el subnivel de energía en el que se encuentra un orbital, dentro de un cierto nivel energético. El valor de l se designa segun las letra

Número Cuántico magnético (mℓ)
si ℓ=1, existen tres posibilidades de mℓ;estas son: -1, 0, +1. El subnivel p tiene 3 orbitales, que se designan por: px, py y pz.
- Si ℓ=2, existen 5 posibilidades -2, -1, 0, 1, 2. el subnivel d tiene 5 orbitales, que se designan por : dxy, dyz, dxz, dx2- y2, dz2.

- Número cuántico de espín (ms)
El electrón posee su propio número cuántico que da a conocer el sentido de rotación del electrón en torno a su eje cuando se mueve dentro de un orbital. El electrón solo tiene dos posibles sentidos de giro, por lo que se puede tomar valores +1/2 o -1/2 . Cada orbital puede albergar un máximo de dos electrones con espines diferentes.

Suscribirse a:
Comentarios (Atom)