BALANCEO POR TANTEO
AGOTE: El agente oxidante toma electronesARDE: El agente reductor dona electrones
SUSTANCIA OXIDADA: Agente oxidada, la que contiene agente reductor
SUSTANCIA REDUCIDA: La que contiene el agente oxidante
NOTA:*Cuando una ecuación no se puede balancear de reactivos a productos se invierte el proceso es decir se debe balancear de productos a reactivos
*Cuando en una misma molécula un átomo gana y en otro pierde electrones se resta de mayor en menor y se calcula la dirección en sentido contrario
*Si los dos átomos gana o los dos átomo pierden electrones se suman ambos.
PUREZA Y EFICIENCIA
PUREZA: Es cuando un reactivo y tiene un porcentaje de impureza(sustancia que obtiene el reactivo que hace que no sea pura).no deben decir que porcentaje hay de reactivo puro o de las impurezas. hay que sacar el porcentaje de pureza antes de el problema dicho.
EFICIENCIA: Ninguna reacción química debe ser 100% da menos productos del que yo deseo obtener :
*condición que se lleva acabo una reacción
MÉTODO DE SEPARACIÓN
DECANTACIÓN: Se emplea para separar líquidos con densidades diferentes y que no se mezclan entre sí (inmiscibles), como el agua y el aceite. En estos casos, se utiliza un embudo de decantación.-Se vierte la mezcla en el embudo de decantación, asegurándonos antes de que la llave de la parte inferior está cerrada (en posición horizontal), para que la mezcla no salga mientras la vertemos.
-Se deja reposar hasta que ambos líquidos se separan bien.-Se coloca un vaso de precipitados debajo del embudo y se abre la llave. Empezará a salir el líquido más denso (es decir, el que está en la parte inferior de la mezcla).-Cerramos la llave en cuanto haya pasado todo este primer líquido.
-El líquido menos denso seguirá en el embudo. Para recuperarlo, conviene sacarlo por la parte superior de este; así evitaremos contaminarlo con los restos de la otra sustancia que hayan podido quedar en la llave.
-El líquido menos denso seguirá en el embudo. Para recuperarlo, conviene sacarlo por la parte superior de este; así evitaremos contaminarlo con los restos de la otra sustancia que hayan podido quedar en la llave.
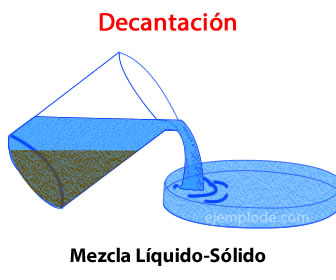
FILTRACIÓN:
Este método se usa para separar un sólido de un líquido en el cual no se disuelve (no es soluble en él), como la arena en suspensión en el agua. Para ello, se hace pasar la mezcla heterogénea a través de un filtro con un tamaño de poro adecuado (menor que el de las partículas que queremos separar). Habitualmente se emplea un papel de filtro acoplado a un embudo
La filtración tiene múltiples aplicaciones tanto a nivel industrial como doméstico. Algunos ejemplos son:
-Filtración del té y otras infusiones
-Filtración del café para separar los granos
-Filtración del agua para potabilizarla
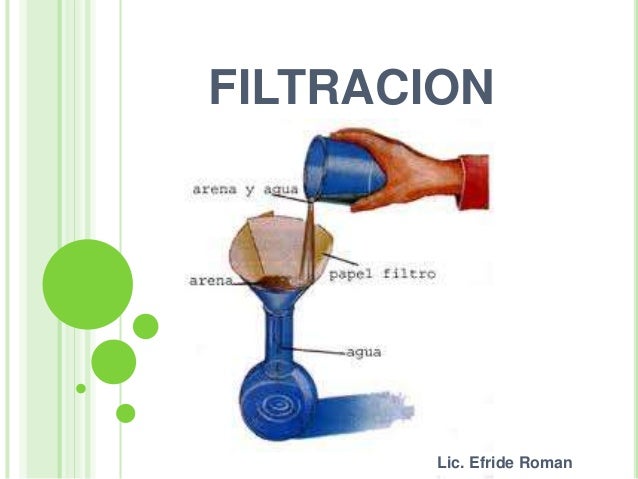
DESTILACIÓN:
Se utiliza para separar líquidos solubles entre sí que tienen temperaturas de ebullición muy diferentes, como el agua y el alcohol La mezcla se vierte en un matraz esférico (o de fondo redondo) y se calienta. Cuando se alcanza la temperatura de ebullición más baja de los componentes, este comienza a convertirse en vapor y pasa por el refrigerante, donde se enfriará y condensará. El líquido resultante, llamado destilado, se recoge en un recipiente (un vaso de precipitados, por ejemplo)
EVAPORACIÓN Y CRISTALIZACIÓN:
Se emplea para separar un soluto sólido disuelto en un disolvente líquido, como la sal en el agua. El proceso comienza con la evaporación del disolvente (natural o forzada mediante calefacción) y acaba con la deposición en el fondo del recipiente (generalmente, un cristalizador) del sólido en forma de cristales. Cuanto más lenta sea la evaporación del disolvente, más grandes serán los cristales.


No hay comentarios:
Publicar un comentario