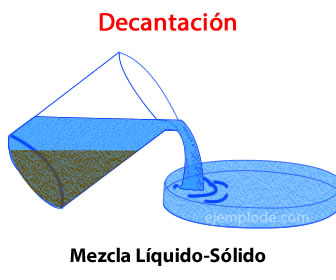
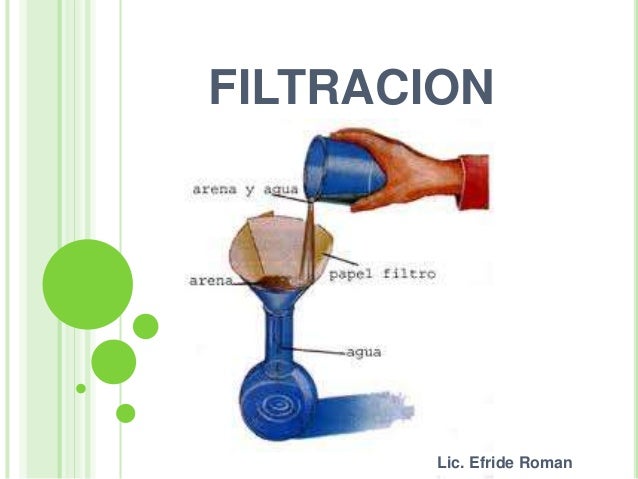
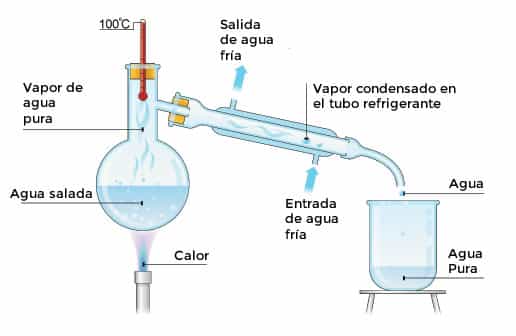
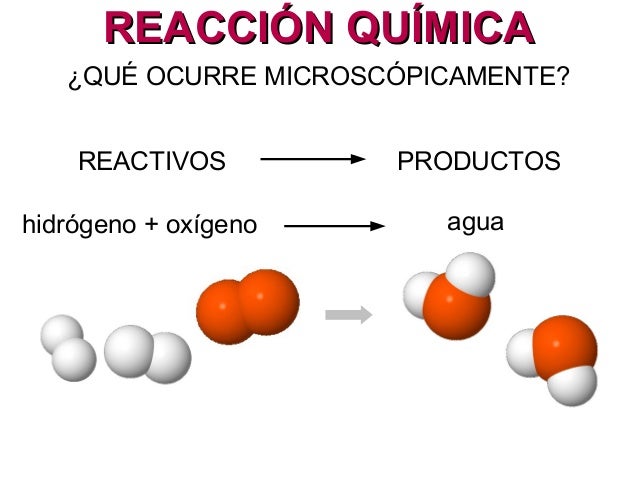
Luego de observar el vídeo, responde las siguientes preguntas
1. Cuáles son las características de una solución?
2. Cuáles son sus componentes?
3. Mensione otros disolventes diferentes al agua que se pueden utilizar en soluciones
4. Qué es la solubilidad y que factores la afectan?
5. A qué se llaman soluciones empíricas y como se dividen?
6. Que son las soluciones valoradas y cuales se mencionan en el vídeo?
SOLUCION
1.R/: -Presentan una sola fase, es decir, son homogéneas.
- -Están formados por dos componentes: soluto y solvente.
2 R/: soluto, solvente y solubilidad
3 R/:Etanol, acetona, y el ete
4 R/: temperatura ,presencia de otro soluto ,tamaño del soluto a disolver, agitación, presión,
5 R/:son aquellas soluciones en las que no conocemos su concentración y se dividen en:
*solución diluidas
*solución concentrada
*solución saturada
*solución sobre saturada
6 R/: *soluciones porcentuales
*soluciones molares